Nguyễn Duy Thăng1, Chế Thị Cẩm Hà2, Nguyễn Thị Hồng Hạnh1,
Nguyễn Văn Tránh1,Trần Văn Lượng1, Tôn Thất Minh Trí1,
Phạm Thị Ngọc Phương1, Trần Thị Phương Túy1
- Bệnh viện TW Huế; 2. Đại học Khoa học Huế
TÓM TẮT
Tế bào gốc ung thư đóng vai trò chính trong quá trình di căn ung thư, chúng có liên kết lỏng lẻo trong khối u và di chuyển tự do trong máu. Việc phát hiện ra tế bào gốc ung thư đã giúp cho các nhà khoa học phần nào giải thích được cơ chế gây ung thư và ngày càng hiểu rõ tại sao bệnh có thể tái phát sau khi điều trị.
Hầu hết các phương pháp điều trị ung thư hiện nay khó có thể điều trị triệt để các tế bào ung thư. Các thành công gần đây trong nghiên cứu ung thư thông qua tế bào gốc ung thư đã mở ra nhiều triển vọng, mang lại nhiều hy vọng mới cho bệnh nhân ung thư.
Từ khóa: Tế bào gốc ung thư
ABSTRACT
PATHOLOGICAL MECHANISM OF CANCER STEM CELL
Nguyen Duy Thang1, Che Thi Cam Ha2, Nguyen Thi Hong Hanh1,
Nguyen Van Tranh1,Tran Van Luong1, Ton That Minh Tri1,
Pham Thi Ngoc Phuong1, Tran Thi Phuong Tuy1
Cancer stem cells plays a key role in the process of cancer metastasis, we have linked loosely in the tumor and have moved freely in the blood. The discovery of cancer stem cells has helped scientists partly explain the mechanism causing cancer and increasingly understand the reason why the disease can recur after the treatment.
Most of the current cancer treatments have hardly treated thoroughly the cancer cells. The recent success in cancer research through Cancer stem cells has opened up many prospects and has brought lots of new hopes for the cancer patients.
Key word: Cancer stem cells
ĐẶT VẤN ĐỀ
Tế bào gốc xuất hiện trong nhiều mô chứa tế bào trưởng thành khác nhau và là thành phần quan trọng trong quá trình sinh lý của mô này. Các quần thể tế bào (population) xuất phát từ những tế bào gốc thường được tổ chức phân bố theo thứ bậc, khi đó tế bào gốc nằm ở đỉnh con đường phát triển của tế bào.
Những tế bào gốc có 3 đặc tính riêng biệt:
- Khả năng tự làm mới (seft renewal).
- Có khả năng kiểm soát số lượng tế bào.
- Khả năng phân chia và biệt hoá thành các tế bào chức năng (lineages) trong các mô chức năng.
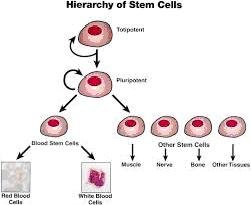
Hình 1: Hệ thống cấp bậc tế bào gốc
Tuy nhiên, thuộc tính “tự đổi mới” cần đặc biệt lưu tâm vì sự mất khả năng tự đổi mới sẽ là yếu tố rất thích hợp cho sự phát sinh ung thư và tạo ra những kiểu hình ác tính. Nhiều nghiên cứu thực hiện trên 30-40 năm, được xem xét một cách chọn lọc cho thấy những thuộc tính của hệ tế bào gốc, những đặc trưng riêng của tế bào gốc như mô tả ở trên hoặc cả hai, rất thích hợp với vài dạng ung thư ở người. Những tế bào này đóng vai trò quan trọng trong sự tăng trưởng của khối u và chúng có khả năng khởi phát một khối u. Các nhà khoa học đã xác định được sự phân bố tương đối ít về số lượng và khác biệt về mặt sinh học của những tế bào“khởi xướng tạo ra u” trong hệ thống tạo máu, não, vú.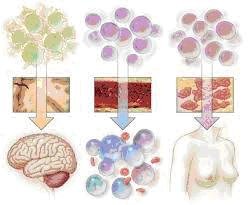
Hình 2: Ví dụ về các tế bào gốc được tìm thấy trong các mô, tổ chức khác nhau. Tế bào gốc thần kinh tạo ra các tế bào trong hệ thống thần kinh trung ương. Tế bào gốc tạo máu tạo ra các tế bào máu trưởng thành. Tế bào gốc vú tạo ra mô vú.
Những tế bào ung thư kiểu nói trên có khả năng tự đổi mới, tiềm năng biệt hóa thành bất kỳ loại tế bào nào. Những đặc tính này của tế bào ung thư khởi xướng tạo u có nét gần gũi với đặc tính của tế bào gốc bình thường (marker bề mặt, khả năng tự làm mới…) chỉ khác ở điểm là chúng không có khả năng kiểm soát số lượng tế bào, chúng tăng sinh mạnh để hướng đến bành trướng liên tục, liên tục và tạo thành những quần thể tế bào ác tính. Những tế bào ác tính với ba đặc tính chức năng như thế được định danh là “tế bào gốc ung thư”. Có lẽ chính chúng là tác nhân gây ra bệnh ung thư. Tuy nhiên có một loạt bằng chứng chỉ ra rằng các tế bào gốc ung thư có thể xuất thân từ các tế bào gốc bình thường cũng như các tế bào tiền thân (progenitor) tạo ra các khối u với động lực, kiểu hình và kiểu gene khác nhau. Những tế bào đầu dòng (những tế bào biệt hóa giai đoạn trung gian “transit-amplying cells”) có thể có khả năng sao chép cần thiết nhưng chúng thường không có khả năng tự đổi mới của một tế bào gốc. Để trở thành tế bào gốc ung thư, một tế bào đầu dòng phải nhiễm sự đột biến để khiến chúng tìm lại tính chất đặc trưng: “tự đổi mới”.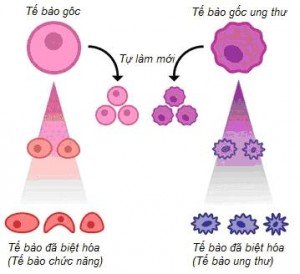
Hình 3: Tế bào gốc ung thư (Cancer Stem Cell – CSC)
Phát hiện này đã giúp cho các nhà khoa học ngày càng hiểu rõ hơn về cơ chế gây ung thư, về khả năng có nhiều cách và nhiều công đoạn sinh ra tế bào gốc ung thư [16].
Mặc dù các nét đặc trưng tế bào gốc bình thường ít nhiều bảo tồn trong tế bào gốc ung thư, xét về sinh học khối u, sẽ phát sinh vấn đề mấu chốt là xem xét kỹ lưỡng các nhóm nhỏ tế bào trong một khối u – tế bào gốc ung thư – là yếu tố thiết yếu cho tăng trưởng khối u. Tuy nhiên, khái niệm tế bào gốc ung thư rất khác biệt trong từng hoàn cảnh.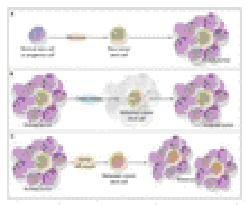 Hình 4: Tế bào ung thư có thể là nguồn cho các tế bào ác tính trong u nguyên phát, chúng có thể tạo ra một nơi dự trữ nhỏ gồm những tế bào đề kháng thuốc chống ung thư, từ đó có trách nhiệm về hiện tượng tái phát sau khi đã giảm bệnh nhờ hóa trị liệu hoặc chúng phát sinh di căn tới nơi xa.
Hình 4: Tế bào ung thư có thể là nguồn cho các tế bào ác tính trong u nguyên phát, chúng có thể tạo ra một nơi dự trữ nhỏ gồm những tế bào đề kháng thuốc chống ung thư, từ đó có trách nhiệm về hiện tượng tái phát sau khi đã giảm bệnh nhờ hóa trị liệu hoặc chúng phát sinh di căn tới nơi xa.
Những nét tiêu biểu sinh học của tế bào gốc ung thư trong mỗi trường hợp này có thể khác nhau, tùy thuộc vào việc thu nạp kết hợp với quá trình tạo u, bao gồm sự không ổn định về mặt di truyền và đề kháng thuốc phối hợp với tế bào gốc ung thư [10].
Các nghiên cứu về tế bào gốc ung thư đã phần nào giải thích được cơ chế gây bệnh và trả lời được câu hỏi tại sao bệnh có thể tái phát sau khi điều trị (trong những trường hợp u lớn đã bị loại bỏ hoàn toàn và đã hóa trị liệu). Điều này cho thấy rằng tế bào gốc ung thư không bị hủy diệt hoàn toàn và chúng có cơ chế bảo vệ và lẫn trốn. Hơn nữa chúng lại có khả năng chịu đựng phóng xạ và hoá trị liệu, vì vậy, hầu hết các phương pháp điều trị ung thư hiện nay khó có thể điều trị tận gốc tế bào gốc ung thư. Với đặc tính là có liên kết lỏng lẻo trong khối u và có thể di chuyển tự do trong máu, vì vậy tế bào gốc ung thư đóng vai trò chính trong quá trình di căn. Chiến lược điều trị nhắm vào chính tế bào gốc ung thư một cách đặc hiệu nhất định sẽ loại bỏ triệt căn u hiệu quả hơn những phương cách điều trị hiện hành và làm giảm nguy cơ tái phát và di căn.
- TẾ BÀO GỐC UNG THƯ TRONG HỆ THỐNG TẠO MÁU
Hệ thống tạo máu là một mô tế bào thân mang đặc trưng rõ nét nhất về phương diện sinh học tế bào gốc. Các ung thư tế bào tạo máu như leukemia rõ ràng khác với các khối u đặc nhưng một số khía cạnh sinh học tế bào gốc tạo máu là hữu ích cho việc hiểu biết những nguyên lý vốn phong phú của sinh học về tế bào gốc ung thư.
Những kiểu khác nhau của bệnh leukemia và tế bào gốc ung thư từng được xác định rõ rệt, nhất quán (unequivocal) và một vài đặc trưng sinh học của tế bào gốc được tìm thấy có thể ứng dụng trực tiếp cho điều trị.
Tế bào gốc ung thư được dễ dàng nhận thấy trong bệnh bạch cầu dòng tủy mãn (chronic myeloid leukemia-CML) và bạch cầu dòng tủy cấp (acute myeloid leukemia-AML) và chúng thường được hàm ý có liên quan trong bạch cầu cấp nguyên bào lympho (acute lymphocytic leukemia-ALL). Những tế bào gốc CML đã có phenotype tế bào gốc được mô tả rõ ràng và chúng cũng có tình trạng chu kỳ im lặng (quiescent cell-cycle status). Tương tự, tế bào gốc ung thư AML hầu như im lặng, điều này gợi ý rằng phương thức gây độc tế bào chống tăng sinh có vẻ không hiệu quả để chống lại các loại bệnh như trên.Tế bào gốc của AML từng có marker bề mặt như chuỗi của receptor của IL-3, Những marker này không gặp ở tế bào gốc bình thường và chúng hữu ích cho việc dùng phương thuốc điều trị ung thư dựa trên phản ứng kháng nguyên kháng thể (ức chế IL3) hay các phương pháp liên quan tới các marker này. Những nỗ lực ban đầu đã chỉ ra sự hữu ích việc dùng các kháng thể chống lại kháng nguyên CD33 trong điều trị AML, những báo cáo gần đây cho thấy rằng CD33 được quy định bằng những gene trên một vài tế bào gốc bệnh bạch cầu. Sự phát triển không ngừng các phương pháp miễn dịch điều trị (immunotherapy) nhằm vào các kháng nguyên đặc hiệu ở tế bào gốc rất được quan tâm, phát triển [4].
Đã từng có các nghiên cứu rộng rãi về những loại thuốc nhằm điều hòa một cách đặc biệt những con đường tác động đến sự tăng trưởng tế bào bệnh bạch cầu (những tác nhân “đích”). Việc dùng chất ức chế kinase ABL- imatinib mesylate (Gleevec) để điều trị CML đã có kết quả đáng lưu ý. Tuy nhiên dù đạt được đáng kể về lâm sàng bằng imatinib nhưng bệnh vẫn còn tồn tại dai dẳng trong nhiều bệnh nhân. Những nghiên cứu thực nghiệm chỉ ra rằng sự ức chế sản phẩm đoạn gene chuyển đoạn BCR-ABL trong CML đủ loại bỏ phần lớn hay hoàn toàn tế bào ung thư, trong khi đó thuốc lại không thể loại bỏ hết tế bào gốc CML.
Imatinib cơ bản ảnh hưởng đến con cháu các dòng sinh ra sau này của tế bào gốc ung thư vì thế CML thường tái phát nếu điều trị bị ngừng lại. Hơn nữa những tác nhân mới dasatinib được cải thiện cho điều trị CML, có hiệu quả cho bệnh đề kháng imatinib. Thế nhưng dữ liệu gần đây cho thấy dasatinib cũng thất bại khi không loại bỏ được tế bào gốc ung thư.
Những nét đặc trưng trong cấu tạo phân tử mà chỉ thấy duy nhất ở tế bào gốc bệnh bạch cầu có thể cung cấp những cơ hội can thiệp bằng điều tri. Ví dụ, có bằng chứng về thành lập sự hoạt hóa cả 2 yếu tố thuộc nhân tế bào có kB(NF-kB) và con đường tín hiệu của phosphatidylinositol3’(PI3) kinase trong những tế bào gốc AML.Vì không phải sự hoạt hóa của NF-kB và cũng không phải sự hoạt hóa của phosphatidylinositol3’(PI3) kinase có thể phát hiện trong những tế bào gốc tạo máu bình thường ở trạng thái nghỉ, nên cả 2 yếu tố phân tử này có thể là những đích đặc hiệu u (tumor-specific targets) khi điều trị AML. Hai công trình nghiên cứu với các phương pháp khác nhau, tạo ra sự ức chế theo dược lý học lên NF-kB đã chỉ ra phương pháp triệt căn đặc hiệu tế bào gốc AML trong ống nghiệm mà không kèm theo tác động có hại nào thấy trên tế bào gốc tạo máu bình thường. Một nghiên cứu độc lập cho thấy việc ức chế PI3 kinase đã làm giảm sự tăng trưởng tế bào gốc AML. Tương tự, sự ức chế của rapamycin đối các đích PI3–kinase cuối dòng ở động vật có vú dường như gây tăng hoạt tính của tác nhân hóa trị chống lại tế bào gốc AML. Sự ức chế mTOR đã chặn đứng sự tăng trưởng những tế bào khởi động ung thư máu trong mẫu chuột mắc AML.
Tóm lại, những phát hiện này chứng tỏ rằng những điều trị đặc biệt cho bệnh bạch cầu bằng cách nhắm đích là các tế bào gốc của chúng có thể đạt kết quả tốt sau này.
III. TẾ BÀO GỐC UNG THƯ TRONG HỆ THẦN KINH TRUNG ƯƠNG
Việc phân lập ra những tế bào gốc ung thư của hệ thần kinh trung ương (Central nervous system – CNS) đã từng thành công bằng phương tiện dùng các markers kháng nguyên và bằng khai thác những mẫu nuôi cấy trong thực nghiệm được dùng cho tế bào gốc thần kinh bình thường. Khi được quan sát lần đầu tiên vào năm 1992, những tế bào thần kinh tăng trưởng trên những bề mặt không kết dinh đã cho ra những quả cầu tế bào (Neurospheres), quả cầu này có khả năng cho tế bào tự đổi mới và có thể sinh ra tất cả các loại tế bào cơ bản ở trong não (neurons, tế bào hình sao, oligodendrocyte). Những quả cầu tế bào thần kinh mà trong đó những ngăn riêng chứa tế bào gốc (compartment) được bảo tồn để có thể dễ dàng tách riêng ra từng tế bào đơn độc, một tỷ lệ nhỏ các tế bào này có thể sinh ra những quả cầu tế bào thần kinh mới. Khả năng này khi phát sinh liên tục nhiều thế hệ từ một tế bào đơn dộc được xem như là chứng cứ tự đổi mới (self –renewal) của chúng. Những công trình nghiên cứu gần đây cho thấy rằng những tế bào gốc thần kinh bình thường cho thấy các protein bề mặt tế bào, các kháng nguyên này có thể phát hiện bằng kháng thể chống lại các epitope AC133 (CD 133), một marker thường hay thấy trên tế bào gốc và các tế bào đầu dòng trong những mô khác nhau trong cơ thể [8].
Việc áp dụng những sách lược từng để tạo ra cầu thần kinh đối với những tiêu bản đạt được từ glioma (u tế bào đệm thần kinh) hay việc tinh lọc tế bào có CD133+ từ glioma người cho phép phân lập và phát triển những quần thể tế bào gốc tạo u. Trong cả 2 trường hợp trên, quần thể tế bào gốc ung thư là cần thiết cho việc tạo u trong cơ thể. Việc cấy ghép số ít khoảng 100 tế bào u glioma người có CD133+ vào trong những não chuột bị làm giảm miễn dịch để khởi động cho sự phát triển một glioma, trái lại không u nào xuất hiện từ việc cấy 105 các tế bào CD133‑ negative, những tế bào này lấy từ cùng một glioma.
|
|||||||||||
|
|
||||||||||
|
|||||||||||
|
|
||||||||||
Các nghiên cứu đã cho thấy rằng những biểu hiện gene của các đặc tính giống tế bào gốc trong u thần kinh trung ương không cần thiết gợi ý rằng, những tế bào này xuất phát từ tế bào gốc.Trong thực nghiệm, những biểu hiện của các gene ung thư tương tác (co-operating oncogenes) trong những tế bào đầu dòng biệt hóa (lineage restricted progenitor) trong thế hệ thần kinh trung ương có thể tạo u mang những đặc tính tế bào bệnh học của các u thần kinh ác tính ở CNS (như Glioblastoma multiforme). Cụ thể, biểu hiện gene sinh ung thư ras và myc trong tế bào tiền thân của oligodendrocytes sẽ tạo ra những tế bào dễ dàng tạo u khi được cấy trong các mô cơ thể. Những nghiên cứu này gợi ý rằng một tế bào gốc ung thư không nhất thiết một tế bào gốc đặc hiệu từng mô nhưng thay vào đó chúng có thể nảy sinh từ những tế bào đầu dòng có định dạng hình thái học (committed). Tế bào này thu thập những đặc tính cơ bản giống tế bào gốc ung thư khi tế bào này đã trải qua sự chuyển dạng do chất gây ung thư tạo ra [9].
Hướng phát triển chống lại tế bào ung thư trong não phần nào phải tiếp tục trải qua trong vài năm nữa.Việc công bố những hiểu biêt về tế bào gốc và những tế bào đầu dòng cấu tạo nên CNS đã đủ tiến bộ cho phép phân tích theo phương pháp bên những quần thể tế bào này cùng với những tế bào u thần kinh trung ương. Hơn nữa một thuận lợi lớn khi nghiên cứu hệ thần kinh trung ương là tất cả những quần thể tế bào tiền đầu dòng lớn (đang nhân bản) có thể có được tăng trưởng dưới dạng quần thể thuần khiết với khả năng phân chia mở rộng của các tế bào gốc và các tế đầu dòng trong thực nghiệm [14], [15].
Do đó, nó dễ dàng được chỉ đạo bằng phân tích trong theo kỹ thuật high– throughput để tìm những hợp chất giết tế bào ung thư chọn lọc và không gây chết cho tế bào bình thường.
- NHỮNG TẾ BÀO GỐC TRONG VÚ
Ngoài những ung thư hệ tạo máu và CNS, ung thư thứ ba cơ bản ở người trong đó tế bào gốc ung thư đã được xác định rõ ràng đó là ung thư vú.
Nghiên cứa Al-Hajj và cs: những mẫu khác nhau của giai đoạn trên ung thư vú di căn cho thấy một loại kháng nguyên bề mặt đặc hiệu CD44 – dương tính và CD24 – âm tính có thể tạo ra khiến tự chúng như một kiểu ghép u ngoại lai, khác loài ( tumor xenograft) [1], [11].
Những thí nghiệm được tiến hành với chuột làm suy giảm hệ miễn dịch và các tế bào được cấy vào đệm mỡ vú chuột để tạo ra môi trường ung thư vú ở người. Cũng như quan sát trong những nghiên cứu tương đồng trên AML và Glioma thì phân nhóm tế bào gốc ung thư tương đối hiếm có thể lan truyền thành ung thư trên chuột, trái lại những tế bào chuột ác tính thì không thể hiện các giai đoạn tiến triển của khối u. Hơn nữa những tế bào tinh khiết CD44+ và CD24‑ có thể biệt hóa và tạo ra những tế bào trong quần thể tế bào ung thư khối u lớn [2], [3], [18].
Việc xác định những đặc tính 2 loại tế bào gốc bình thường và tế bào gốc ung thư vú đã có tiến bộ nhanh. Những nghiên cứu gần đây đã cung cấp hiện tượng đặc trưng hóa chi tiết cho tế bào gốc bình thường của nó ở chuột và chỉ ra những tế bào tiềm năng về mặt chức năng của các tế bào như thể bởi chúng có khả năng tái sinh hoàn toàn tuyến vú khi được cấy vào môi trường của vật chủ phù hợp. Bằng những công cụ thực nghiệm với việc đưa ra những đặc trưng cơ bản của tế bào gốc vú bình thường, nên làm rõ hơn nữa những đặc trưng sinh học của tế bào gốc ung thư ở vú hẳn chỉ là không sớm thì muộn thôi [12], [13].
- THÁCH THỨC CỦA ĐIỀU TRỊ ĐÍCH NHẰM VÀO NHỮNG TẾ BÀO GỐC UNG THƯ
Sự phát triển điều trị với đích ngắm là tế bào gốc ung thư là một chủ đề quan trọng nhưng những thách thức thì đáng kể.
– Thứ nhất: để thiết kế điều trị sao cho mang tính chọn lọc nhằm loại bỏ các tế bào gốc ung thư không ảnh hưởng tế bào bình thường. Nó hữu ích khi có các tế bào gốc bình thường và các tế bào đầu dòng cùng họ hàng. Bước này đòi hỏi phát triển những thử nghiệm để tìm những nét mang tính cá nhân ở chức năng tế bào gốc bình thường (characterization) và các phương tiện để định nghĩa được những nét đặc trưng thực thể (marker kháng nguyên bề mặt tế bào) qua đó chúng ta có thể phân lập các tế bào này. Không có hiểu biết này chúng ta không thể biết thuốc đề xuất sử dụng có độc với tế bào bình thường hay không.
– Thứ hai: chúng ta phải có cách thức tương tự như tế bào gốc bình thường để mô tả tế bào gốc ung thư và phải đưa ra cách thức thử nghiệm chức năng phù hợp với chúng.
– Thứ ba: phải nghiêm túc khi hiểu tại sao một tế bào gốc ung thư có sự khác biệt với các tế bào bình thường ở chỗ điều khiển hiện tượng sống sót tế bào và cách đáp ứng với những thương tổn. Lý tưởng là một trị liệu nên có đích ngắm vào những phướng cách duy nhất mà chỉ tế bào gốc ung thư dùng đề kháng lại các tấn công bên ngoài hay để duy trì khả năng sống ổn định, vững chãi.
– Thứ tư: chúng ta phải hiểu liệu pháp điều trị nào đó tại sao nhắm có hiệu quả vào một số lượng lớn tế bào trong u thì thất bại khi không loại bỏ được tế bào gốc ung thư.
Những lý do của các hiện tượng này có thể cung cấp đầu mối quan trọng để phát triển các phương thức, cách thức hiệu quả và thấu đáo để tấn công cả tế bào trong khối ung thư và tế bào gốc u đó [16], 17].
Một thách thức nữa khi nhắm đích vào tế bào gốc ung thư cần phải hiểu tại sao tế bào gốc ung thư khó bị giết bởi chúng có những đặc tính đặc hiệu. Những tế bào gốc ung thư bạch cầu có thể cư ngụ trong trạng thái chu kỳ tế bào im lặng như các thành viên bình thường khác. Hậu quả là các cách thức gây độc tế bào mà nhắm đích nhanh vào tế bào đang phân chia hình như không loại bỏ những tế bào trong trạng thái im lặng như vậy [6], [7].
Nhắm đích chọn lọc do đó đòi hỏi các cách thức trị bệnh phải giết các tế bào độc lập trong chu kỳ của tế bào hay tạo cảm ứng có chọn lọc lên chu kỳ tế bào gốc ung thư gốc ung thư. Một nét chung là các tế bào gốc ung thư hay có các biểu hiện gene cho các protein kết hợp với tạo ra ào ạt các độc tố ngoại lai sinh học (như protein đề kháng đa thuốc và những thành viên trong họ vận chuyển các ATP kết hợp với cassette [ABC] (ATP-binding cassete [ABC] transporter family). Một số biến thể của nhiều tế bào, đặc biệt trong quá trình tái phát có biểu hiện gen một số protein như thế, thì sẽ tạo sự kháng các thuốc hóa học dùng điều trị ung thư.
Hơn nữa trong phạm vi nào đó, các tế bào gốc ung thư có thể huy động tất cả các phương tiện được cung cấp do lịch sử tiến hóa để bảo vệ các tế bào gốc bình thường mà chúng ta vẫn chưa biết rõ,nhưng thông tin này có ý nghĩa sinh học lẫn lâm sàng.
Một quan ngại nữa là tế bào gốc bình thường và các tế bào đầu dòng có thể nhạy cảm hơn với các ảnh hưởng hóa trị liệu so với tế bào gốc ung thư. Những tế bào gốc đại tràng bình thường, có thể ức chế sửa chữa DNA và do đó trải qua apoptosis-chết tế bào khi gặp thương tổn DNA. Cơ chế này giúp tránh các đột biến có hại tích lũy trong cơ thể. Tuy vậy nếu những tế bào gốc ung thư đại tràng bỏ qua cơ chế bảo vệ này, chúng không chết tế bào, suy ra liệu pháp hóa trị có vẻ thích hợp hơn khi sử dụng chúng.
Những nghiên cứu gần đây chỉ ra rằng những tế bào gốc máu bình thường trải qua quá trình già sớm (già sớm tế bào) khi bộc lộ với chiếu xạ ion hóa hay dùng busulfan. Điều này làm suy giảm sự phát triển và tiềm năng tăng trưởng của tế bào gốc tạo máu. Nếu tế bào gốc bệnh bạch cầu không trải qua quá trình lão hóa như dự đoán bởi các nghiên cứu gần đây theo thuyết nguồn gốc sinh ung thư thì chúng ta trông mong những tế bào gốc ác tính nhất định phải có sự tiến bộ về tăng trưởng sau khi điều trị ung thư bằng một số tác nhân nào đó. Hơn nữa có thể cho rằng những chu kỳ hóa trị liệu liên tục chỉ làm tăng thêm trầm trọng tình trạng bệnh bởi gia tăng tổn thương cho các hồ chứa tế bào gốc bình thường (bằng cách gây lão hóa) và đồng thời cũng gia tăng thuận lợi tăng trưởng cho các tế bào gốc ung thư tăng, tình huống này kháng lại sự lão hóa tế bào ung thư. Rõ ràng những hiểu biết rõ hơn về tế bào gốc bình thường và tế bào gốc ung thư có tầm quan trọng rất nhiều không chỉ khi thiết kế các phương pháp điều trị mới mà còn quan trọng trong hiểu rõ những hậu quả sinh học và lâm sàng của chế độ điều trị đang ứng dụng hiện tại [5].
Nếu người ta thành công khi làm giảm bệnh ung thư thì việc có mặt những tế bào gốc sót lại đề kháng thuốc sẽ khởi động tái phát bệnh, do vậy chúng ta phải phát triển các phương pháp tốt hơn để phát hiện và định lượng tế bào gốc ung thư trong những bệnh nhân đang nhận liệu pháp điều trị ung thư. Những phát hiện chưa rõ ràng trong bệnh bạch cầu chứng tỏ rằng mức độ bệnh tái phát trực tiếp liên quan với kết quả đầu ra lâu dài. Nếu số lượng tế bào ung thư bạch cầu nguyên thủy có thể giảm xuống dưới một mức ở ngưỡng chuẩn, nó có thể không cần để loại hoàn toàn dòng (clone) ác tính. Có hay không những tế bào tồn dư thực sự là tế bào gốc sinh ung thư, chúng ta còn phải cân nhắc nhưng những tìm thấy mang ý nghĩa gợi ý rằng các phương pháp thời gian thực có độ nhạy (sensitive real time methods) để phát hiện tế bào gốc phải được ưu tiên hàng đầu.
Trong việc thiết kế các phương cách đặc hiệu cho tế bào gốc vào chiến lược nên được xét đến tình huống được cho phương thức điều hòa bị hư tổn là trung tâm của bệnh lý, nghĩa là nhắm vào các phương thức làm trung gian cho quá trình tự đổi mới tế bào cách thức thích hợp hấp dẫn nhất. Một yếu tố quan trọng chưa được biết rõ là cấp độ nào đó ức chế sự vận hành quá trình tự đổi mới, có thể chấp nhận được. Bởi vì những phương thức điều khiển sự đổi mới trung tâm cho mới nhiều dạng chức năng sinh học khác nhau. Tuy nhiên thậm chí khi ta nhắm vào những cách thức tế bào tự đổi mới là dễ dàng, chúng ta cũng không biết điều này có thể giết tế bào gốc hay đơn giản chỉ ngăn chặn nó. Vì những lý do này, cách này hay khác là phải can thiệp vào các con đường sống sót-đặc hiệu- của tế bào gốc. Ví dụ chiến lược ức chế những cơ chế tồn tại hay những giai đoạn ôxy hóa của tế bào có thể gây độc chọn lọc trên tế bào gốc ung thư bạch cầu. Liệu pháp dựa trên kháng thể hay liệu pháp dựa trên Ligand có thể là phương pháp hứa hẹn để phá hủy tế bào ung thư. Một số nhỏ kháng nguyên đích trên tế bào gốc ung thư đã được mô tả và với tạo đặc trưng (characterization). Thêm nữa cho các quần thể tế bào thuần khiết, chúng ta có những mục tiêu nữa trong trị liệu có sẵn. Vấn đề cần quyết định, các đích này hay đích khác có phân biệt được tế bào ung thư hay tế bào bình thường hay không.
- KẾT LUẬN
Hiện tại có nhiều bằng chứng cho thấy những đặc tính của tế bào gốc rất hữu ích với sinh vật học của vài ung thư ở người. Tuy nhiên, vẫn tồn tại nhiều thắc mắc quan trọng. Cơ bản nhất, trong phạm vi nào đó chúng ta vẫn phải quyết định xem sinh vật học có phải là tương quan với tất cả các dạng cơ bản ung thư ở người, vì lí do này, thật quá sớm khi phóng đại về vai trò chung của tế bào gốc trong ung thư. Dẫu sao, việc triệt căn những tế bào gốc ung thư sẽ là điều cần thiết để cải thiện kết quả điều trị cho ít nhất một vài bệnh ung thư. Một câu hỏi lý thú rằng các loại ung thư khác nhau của tế bào gốc ung thư có cùng điểm yếu hay không, điều này có thể được quyết định cùng với một cơ chế tăng trưởng và sống sót mang tính đặc hiệu u giống nhau là chủ động thông qua nhiều loại ung thư hay không. Bởi vì một số nét tiêu biểu của tế bào gốc bình thường đã được bảo tồn trong những mô khác nhau, việc quyết đinh có sự bảo tồn tương tự như trên xảy ra trong số những tế bào gốc gây ung thư hay không, sẽ hữu ích khi chúng ta thiết kế các phương pháp điều trị mới.
Vấn đề quan trọng khác khi điều tra là bằng cách nào khi những tác nhân điều trị hóa trị liệu hiện tại đã ảnh hưởng lên sự tiến hóa của tế bào gốc ung thư trong thời kỳ sử dụng những phương thức điều trị thường quy? Câu hỏi này liên quan đến cả tính nhạy cảm của tế bào gốc bình thường khi so với những tế bào gốc ác tính và những cơ chế mà qua đó đề kháng thuốc đã xuất hiện. Có phải những dạng điều trị hiện thời đã cung cấp những thuận lợi có tính cạnh tranh đối với các tế bào gốc ung thư và nếu thế có phải áp lực của chọn lọc tự nhiên đã dẫn đến sự xuất hiện đề kháng thuốc trong những tế bào gốc ung thư?
Cuối cùng, sẽ thật cần thiết để đánh giá điểm cuối ung thư trên lâm sàng, người ta xem xét thành công của điều trị ở tại điểm này. Việc loại bỏ các khối u lớn hình như không dự báo trước được hiệu quả của cách điều trị bằng thuốc cho những tế bào ung thư hiếm gặp. Do vậy, việc phát triển các phương pháp thử nghiệm để đo lường tình trạng sống sót của tế bào gốc ung thư sẽ là rất quan trọng cho việc đánh giá tiềm năng của các cách thức điều trị mới theo liệu pháp đích (new targeted regimens) trong ung thư.
Với các thành công gần đây trong nghiên cứu ung thư thông qua tế bào gốc ung thư đã mở ra nhiều triển vọng cho các phương pháp trị liệu: phương pháp phân biệt chức năng các quần thể tế bào trong khối u, phương pháp nhận diện và kiểm tra các liệu pháp kháng ung thư trực tiếp trên khối u, điều này mang lại nhiều hy vọng chữa trị cho tất cả bệnh nhân ung thư. Giáo sư Parada, Đại học Texas, cho rằng ông tin sẽ có một phương pháp tiếp cận mới trong việc phát triển các hướng điều trị ung thư mới: “Tế bào gốc ung thư đã làm thay đổi mô hình nghiên cứu. Mục tiêu làm giảm kích cỡ khối u có thể không còn quan trọng bằng xác định đúng những tế bào ung thư trong khối u đó”.
TÀI LIỆU THAM KHẢO
- Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF (April 2003), “Prospective identification of tumorigenic breast cancer cells”, Proceedings of the National Academy of Sciences of the United States of America, 100 (7), pp. 3983–8.
2.Anido, J; Sáez-Borderías, A; Gonzàlez-Juncà, A; Rodón, L; Folch, G; Carmona, MA; Prieto-Sánchez, RM; Barba, I; Martínez-Sáez, E; Prudkin, L; Cuartas, I; Raventós, C; Martínez-Ricarte, F; Poca, MA; García-Dorado, D; Lahn, MM; Yingling, JM; Rodón, J; Sahuquillo, J; Baselga, J; Seoane, J (2010), “TGF-β Receptor Inhibitors Target the CD44(high)/Id1(high) Glioma-Initiating Cell Population in Human Glioblastoma”, Cancer Cell, 18 (6), pp. 655–68
3. Bonnet D, Dick JE (July 1997), “Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell”, Nature Medicine 3(7), pp. 730–7.
4. Brabletz, T; Jung, A; Spaderna, S; Hlubek, F; Kirchner, T (September 2005), “Opinion: migrating cancer stem cells – an integrated concept of malignant tumour progression”, Nature Reviews Cancer, 5(9), pp. 744–9
5. Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CH, Jones DL, Visvader J, Weissman IL, Wahl GM (October 2006), “Cancer stem cells–perspectives on current status and future directions: AACR Workshop on cancer stem cells”, Cancer Research, 66(19), pp. 9339– 44.
6. Dalerba, P; Dylla, SJ; Park, IK; Liu, R; Wang, X; Cho, RW; Hoey, T; Gurney, A; Huang, EH; Simeone, DM; Shelton, AA; Parmiani, G; Castelli, C; Clarke, MF (J2007), “Phenotypic characterization of human colorectal cancer stem cells”
7. Dirks, P (2010), “Cancer stem cells: Invitation to a second round”, Nature, 466(7302), pp. 40–1.
8. Gupta PB, Chaffer CL, Weinberg RA (2009), “Cancer stem cells: mirage or reality?”, Nat Med, 15(9), pp. 1010–2.
9. Kemper, K; Sprick, MR; de Bree, M; Scopelliti, A; Vermeulen, L; Hoek, M; Zeilstra, J; Pals, ST; Mehmet, H; Stassi, G; Medema, JP (2010), “The AC133 epitope, but not the CD133 protein, is lost upon cancer stem cell differentiation”, Cancer Research, 70(2), pp. 719– 29.
10. Mazzoleni, S; Politi, LS; Pala, M; Cominelli, M; Franzin, A; Sergi Sergi, L; Falini, A; De Palma, M; Bulfone, A; Poliani, PL; Galli, R (2010), “Epidermal growth factor receptor expression identifies functionally and molecularly distinct tumor-initiating cells in human glioblastoma multiforme and is required for gliomagenesis”, Cancer Research, 70(19), pp. 7500–13
11. Mukherjee, Siddhartha (2014), “The Cancer Sleeper Cell”, New York Times, New York Times.
12. Liu, C; Kelnar, K; Liu, B; Chen, X; Calhoun-Davis, T; Li, H; Patrawala, L; Yan, H; Jeter, C; Honorio, S; Wiggins, JF; Bader, AG; Fagin, R; Brown, D; Tang, DG (2011), “The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44”, Nature Medicine, 17(2), pp. 211–5
13. O’Brien, CA; Pollett, A; Gallinger, S; Dick, JE (J2007), “A human colon cancer cell capable of initiating tumour growth in immunodeficient mice”, Nature, 445(7123), pp. 106–10.
14. Odoux, C; Fohrer, H; Hoppo, T; Guzik, L; Stolz, DB; Lewis, DW; Gollin, SM; Gamblin, TC; Geller, DA; Lagasse, E (2008), “A stochastic model for cancer stem cell origin in metastatic colon cancer”, Cancer Research, 68(17), pp. 6932–41
15. Pece, S; Tosoni, D; Confalonieri, S; Mazzarol, G; Vecchi, M; Ronzoni, S; Bernard, L; Viale, G; Pelicci, PG; Di Fiore, PP (2010), “Biological and molecular heterogeneity of breast cancers correlates with their cancer stem cell content”, Cell, 140(1), pp. 62–73.
16. Shipitsin, M; Campbell, LL; Argani, P; Weremowicz, S; Bloushtain-Qimron, N; Yao, J; Nikolskaya, T; Serebryiskaya, T; Beroukhim, R; Hu, M; Halushka, MK; Sukumar, S; Parker, LM; Anderson, KS; Harris, LN; Garber, JE; Richardson, AL; Schnitt, SJ; Nikolsky, Y; Gelman, RS; Polyak, K (2007), “Molecular definition of breast tumor heterogeneity”, Cancer Cell, 11(3), pp. 259–73
17. Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB (2003), “Identification of a cancer stem cell in human brain tumors”, Cancer Research, 63(18), pp. 5821–8
18. Singh, SK; Hawkins, C; Clarke, ID; Squire, JA; Bayani, J; Hide, T; Henkelman, RM; Cusimano, MD; Dirks, PB (2004), “Identification of human brain tumour initiating cells”, Nature, 432(7015), pp. 396–401
19. Thiery, JP (2002), “Epithelial-mesenchymal transitions in tumour progression”, Nature Reviews Cancer, 2(6), pp. 442– 54
20. Visvader, JE; Lindeman, GJ (2008), “Cancer stem cells in solid tumours: accumulating evidence and unresolved questions”, Nature Reviews Cancer, 8(10), pp. 755– 68.
21. Y Liu, R Nenutil, M V Appleyard, K Murray, M Boylan, A M Thompson and P J Coates (2014), Lack of correlation of stem cell markers in breast cancer stem cells, Molecular Diagnostics, British Journal of Cancer, 110, pp. 2063- 2071.
 Hội Nội tiết và Đái Tháo đường Thừa Thiên Huế
Hội Nội tiết và Đái Tháo đường Thừa Thiên Huế