Nguyễn Hải Thủy
- Trường Đại học Y Dược Huế
ABSTRACT
Hypoglycemia in diabetic patient has been potentially linked to functional brain failure and cardiovascular morbidity and mortality.
Pathophysiologically, hypoglycemia triggers activation of the sympathoadrenal system, leading to an increase in counter-regulatory hormones and, consequently, increased myocardial workload and oxygen demand. Additionally, hypoglycemia triggers proinflammatory and hematologic changes that provide the substrate for possible myocardial ischemia in the already-diseased diabetic cardiovascular system. Hypoglycemia creates electrophysiologic alterations causing P-R–interval shortening, ST-segment depression,T-wave flattening, reduction of T-wave area, and QTc-interval prolongation. Patients who experience hypoglycemia are at an increased risk of silent ischemia as well as QTc prolongation and consequent arrhythmias. Hypoglycemia commonly causes brain fuel deprivation, resulting in functional brain failure, which can be corrected by raising plasma glucose concentrations. Rarely, profound hypoglycemia causes brain death that is not the result of fuel deprivation per se. Suh and colleagues use cell culture and in vivo rodent studies of glucose deprivation and marked hypoglycemia and provide evidence that hypoglycemic brain neuronal death is in fact increased by neuronal NADPH oxidase activation during glucose reperfusion. This finding suggests that, at least in the setting of profound hypoglycemia, therapeutic hyperglycemia should be avoided.
cardiovascular system. Hypoglycemia creates electrophysiologic alterations causing P-R–interval shortening, ST-segment depression,T-wave flattening, reduction of T-wave area, and QTc-interval prolongation. Patients who experience hypoglycemia are at an increased risk of silent ischemia as well as QTc prolongation and consequent arrhythmias. Hypoglycemia commonly causes brain fuel deprivation, resulting in functional brain failure, which can be corrected by raising plasma glucose concentrations. Rarely, profound hypoglycemia causes brain death that is not the result of fuel deprivation per se. Suh and colleagues use cell culture and in vivo rodent studies of glucose deprivation and marked hypoglycemia and provide evidence that hypoglycemic brain neuronal death is in fact increased by neuronal NADPH oxidase activation during glucose reperfusion. This finding suggests that, at least in the setting of profound hypoglycemia, therapeutic hyperglycemia should be avoided.
- TỔN THƯƠNG THẦN KINH TRONG HẠ ĐƯỜNG HUYẾT
- Suy chức năng não
Trong trạng thái sinh lý glucose là nhiên liệu trao đổi chính và bắt buộc đối với tế bào não. Những quan tâm gần đây trong các nhiên liệu thay thế của não bao gồm lactate có nguồn gốc từ thoái biến kỵ khí glucose phần lớn trong tế bào não. Do não không thể tổng hợp glucose hoặc lưu trữ một lượng đáng kể dưới dạng glycogen trong tế bào hình sao, vì thế não đòi hỏi một nguồn cung cấp glucose gần như liên tục từ máu lưu thông. Tạo điều kiện khuếch tán glucose từ máu vào não bộ là một chức năng trực tiếp của nồng độ glucose huyết tương động mạch. Tỷ lệ vận chuyển glucose từ máu đến não vượt quá tỷ lệ chuyển hóa glucose tại não khi nồng độ glucose huyết tương bình thường (hoặc tăng), nhưng ngược lại khi nồng độ glucose giảm và bị hạn chế chuyển hóa glucose não khi nồng độ glucose máu động mạch giảm xuống ở mức thấp .Vì vậy, hạ đường huyết gây thiếu nhiên liệu sự dụng và kết quả là não bị suy chức năng não.
Sơ đồ 1. Não là cơ quan duy nhất phụ thuộc năng lượng vào chuyển hóa của glucose. Biểu đồ trên phản ánh tình trạng phản ứng não đối với hạ đường huyết. Biểu hiện lâm sàng hiếm khi xãy ra khi nồng độ glucose máu ˃ 60 mg/dl. Qua mô hình có năm giai đoạn liên quan đến hạ đường máu , Mổi giai đoạn liên quan đến sự phân chia giải phẩu khác nhau, trong đó trung tâm cao nhất của não sự nhạy cảm và ảnh hưởng sớm nhất.
Các chuỗi phản ứng khi nồng độ glucose huyết tương bắt đầu giảm ghi nhận ban đầu là kích hoạt hệ thống bảo vệ chống hạ đường huyết bao gồm giảm tiết insulin trong tế bào β của tụy khi nồng độ glucose máu giảm trong khoảng (3,9-6,1 mmol/l [70-110 mg/dl]). Giảm tiết insulin khi nồng độ glucose giảm khoảng 4,5 mmol/l (81 mg/dl). Sự gia tăng tiết glucagon tụy và tiết epinephrine (trong phản ứng thần kinh nội tiết khác) thường xảy ra khi nồng độ glucose giảm dưới mức sinh lý (ngưỡng 3,8 mmol/l [68 mg / dl]). Nếu những sự bảo vệ trên bị thất bại trong chấm dứt các giai đoạn hạ đường huyết, khi nồng độ glucose thấp sẽ kích hoạt dữ dội hơn phản ứng giao cảm thương thận (sympathoadrenal) gây các triệu chứng thần kinh (hoặc thần kinh tự động). Triệu chứng não thiếu đường (neuroglycopenic) xảy ra tại nồng độ glucose khoảng 3,0 mmol / l (54 mg / dl).
Nhận thức về các triệu chứng của hạ đường huyết, đặc biệt là các triệu chứng thiếu đường thần kinh, nhằm nhắc nhở các phản ứng bảo vệ theo thói quen, tiêu hóa thức ăn. Nếu tất cả những phản ứng bảo vệ trên thất bạị, nồng độ glucose thấp gây suy giảm chức năng não có thể tiến triển đi từ suy giảm nhận thức (ngưỡng 2,8 mmol/l [50 mg/dl]) cho đến các hành vi bất thường, động kinh và sau cùng là hôn mê.
Hôn mê trong hạ glucose có thể xảy ra khi nồng độ glucose 2,3-2,7 mmol/l (41-49 mg /dl) nhưng cũng có thể nồng độ glucose thấp hơn. Tất cả những phản ứng trên được điều chỉnh sau khi nồng độ glucose huyết tương được nâng lên.
Các cơn hạ đường huyết là một thực tế trên lâm sàng cho hầu hết mọi bệnh nhân ĐTĐ. Trong ĐTĐT1, nồng độ glucose huyết
tương có thể thấp hơn 2,8 mmol/l (50 mg/ dl); trung bình bệnh nhân có hai cơn hạ đường huyết nhẹ có triệu chứng mỗi tuần và một cơn hạ đường huyết nặng thoáng qua mỗi năm. Mặc dù các trường hợp tử vong do điều trị liên quan đến tác dụng của thuốc điều trị (các cơ chế chưa rõ nhưng có thể bao gồm rối loạn nhịp tim), phục hồi hoàn toàn sự suy chức năng não do hạ đường máu sau khi nồng độ glucose huyết tương được nâng lên sớm. Tuy vậy tổn thương thần kinh vĩnh viễn do hạ đường huyết rất hiếm gặp trên lâm sàng.
- Chết não
Hạ đường huyết nặng và kéo dài có thể gây chết não. Trong các nghiên cứu hạ đường huyết khi dùng insulin ở khỉ, duy trì nồng độ glucose trong máu thấp hơn 1,1 mmol / l (20 mg / dl) trong 5-6 giờ nhằm tạo tổn thương thần kinh thường xuyên; mức đường huyết trung bình là 0,7 mmol / l (13 mg / dl).
Hình 1. Hình ảnh tổn thương não ở bệnh nhân hôn mê hạ đường huyết do dùng SU ngày thứ ba
DWI não cho thấy tín hiệu khuếch tán cao trong 2 bên vùng hồi hải mã (hippocampus) (A. mũi tên dày), vỏ thái dương và chẩm (A. mũi tên nhỏ); đồng thời trong hạch nền hai bên (B. mũi tên dày), và chất xám vỏ não chẩm (B. nhỏ mũi tên).
Các cơ chế của hạ đường huyết thường gặp gây suy chức năng não và hiếm hơn hạ đường huyết gây chết não với nồng độ glucose huyết tương khác nhau. Trước đây là cho rằng đây kết quả của não thiếu nhiên liệu nhưng sau này thì không. Suh và các cộng sự phát hiện một loạt các cơ chế liên quan đến chết tế bào thần kinh do hạ đường huyết bao gồm sự phóng thích glutamate và kích hoạt các thụ thể glutamate tế bào thần kinh, tạo sản phẩm oxy phản ứng, phóng thích kẽm tế bào thần kinh, kích hoạt enzyme poly (ADP-ribose) polymerase và chuyển đổi tính thấm ti thể. Suh và các cộng sự bổ sung các cơ chế hoại tử tế bào thần kinh do hạ đường huyết.
Dựa trên hệ thống nuôi cấy tế bào và trong các nghiên cứu động vật gặm nhấm cung cấp glucose sau khi hạ đường huyết ghi nhận sự sản xuất superoxide do hạ đường huyết và chết tế bào thần kinh được gia tăng bởi hoạt hóa NADPH oxidase xãy ra trong quá trình tái cung cấp glucose. Những ảnh hưởng này bị giảm bởi một chất ức chế NADPH oxidase, thiếu hụt của một tiểu đơn vị của enzyme và ức chế tái tạo NADPH , trong số những phát hiện khác.
Đáng chú ý, tổng hợp superoxide và chết tế bào thần kinh tăng lên cùng với sự gia tăng nồng độ glucose trong giai đoạn tái tưới máu sau khi hạ đường huyết, phù hợp với kết quả nghiên cứu trước đây.
Nhằm tái hiện các nghiên cứu về tiên lượng, bao gồm chết tế bào thần kinh, những nghiên cứu này được thực hiện với các nồng độ glucose khác nhau. Trong các nghiên cứu nuôi cấy tế bào, thiếu glucose đã được tạo ra bằng cách sử dụng một phương tiện không chứa glucose, cung cấp glucose đã được tạo ra bằng cách thêm glucose trung bình đạt 10,0 mmol (180 mg / dl), nhiều lần lớn hơn nồng độ glucose dịch ngoại bào não bình thường. Trong các nghiên cứu in vivo, nồng độ glucose máu trung bình 0,4 mmol/l (7 mg/dl), gây ra đẳng điện trên điện não đồ trong khi hạ đường huyết và đạt 7,5 mmol / l (135 mg/dl) trong tái truyền glucose sau hạ đường đã được ghi nhận gây nên các tác động có hại. Sự sản xuất superoxide và chết tế bào thần kinh xảy ra có lẻ như là kết quả của hạ đường huyết, nhưng xảy ra một mức độ lớn hơn khi tái truyền glucose, mức độ thấp hơn khi nồng độ glucose máu sau hạ đường được nâng lên khoảng 1,0-2,0 mmol/l (18-36 mg/ dl) so với khi chúng được nâng lên khoảng 5,0-10,0 mmol/l (90-180 mg/dl). Các nghiên cứu liên quan đến hạ đường huyết nặng đã không được báo cáo.
Sự phân biệt giữa sự suy chức năng não do hạ đường huyết thông thường và chết não do hạ đường huyết rất hiếm gặp, rút ra ở đây có tính võ đoán. Nồng độ glucose huyết tương thấp hơn 1,0 mmol / l (18 mg / dl) xảy ra hiếm hoi ở những người bị bệnh ĐTĐ và chết tế bào não, tế bào thần kinh , đã được ghi nhận sau nhiều cơn hạ đường huyết ở nồng độ glucose huyết tương 1,7-1,9 mmol/ l (30-35 mg / dl) – nhưng không được nghiên cứu theo dõi cơn hạ đường huyết ở nồng độ glucose huyết tương là 2,5 mmol / l (45 mg / dl) – ở chuột . Vì vậy, nó có thể được lý giải theo các thể loại này không phải là 2 cấp độ mà có thể là một phổ liên tục với sự gia tăng nguy cơ chết tế bào thần kinh ở nồng độ glucose huyết tương thấp hơn. Tuy nhiên, hồi phục hoàn toàn sau phần lớn các cơn hạ đường huyết trên lâm sàng.
Suy đoán lâm sàng phù hợp của những dữ liệu này chưa được rõ ràng. Các tác giả chỉ ra rằng nồng độ glucose huyết tương cần phải được nâng lên ở những bệnh nhân hạ đường huyết. Trong bối cảnh lâm sàng thường gặp của suy chức năng não do hạ đường huyết gây ra, nồng độ glucose huyết tương cần được nâng lên trong phạm vi sinh lý kịp thời với mong muốn phục hồi các chức năng não bộ. Tại thời điểm này không có bằng chứng rõ ràng rằng làm tăng đường huyết sau điều trị là bất lợi cho sự phục hồi, nhưng không có lý do gì để nghĩ rằng nó có lợi hoàn toàn trong bối cảnh đó.
Mặt khác, điều trị dưới mức (undertreatment) sẽ trì hoãn sự phục hồi. Trong bối cảnh lâm sàng hiếm của hạ đường huyết nặng và kéo dài, với nguy cơ chết tế bào thần kinh cao hơn, các dữ liệu cho thấy rằng nồng độ glucose huyết tương nên được nâng lên một cách thận trọng với tránh tăng đường huyết quá mức . Tuy nhiên, có vẻ hợp lý khi nâng nồng độ glucose huyết tương vào giới hạn sinh lý (ví dụ > 3,9 mmol/l [70 mg/dl]) kịp thời. Đồng thời cần thiết có nhiều nghiên cứu để bổ sung các vấn đề quan trọng nói trên.
Hình 2. Chuỗi phản ứng theo nồng độ glucose huyết tương giảm. Các đường kẻ liền xác đinh trung bình và các đường đứt nét ngang giới hạn trên và dưới của nồng độ glucose huyết tương sinh lý sau hấp thu ở người. Các ngưỡng đường huyết làm giảm tiết insulin, tăng tiết glucagon và epinephrine, có triệu chứng và giảm nhận thức đã được xác định ở người khỏe mạnh Những cơn động kinh, hôn mê và chết tế bào thần kinh được loại suy từ quan sát lâm sàng ở người và nghiên cứu trên khỉ cũng như ở động vật thực nghiệm khác. Suh và các đồng nghiệp báo cáo rằng tái tưới glucose máu não gây chết tế bào thần kinh trong mô hình động vật gặm nhấm của hạ đường huyết nặng
- BIẾN CỐ TIM MẠCH TRONG HẠ ĐƯỜNG HUYẾT
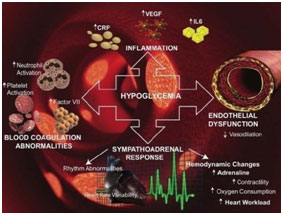
Cơ sở sinh lý bệnh về tiềm năng mắc bệnh và tử vong tim mạch do hạ đường huyết cấp tính, đặc biệt là ở những bệnh nhân có tiền sử ĐTĐ lâu ngày đã được mô tả bởi một số tác giả. Hạ đường huyết cấp gây hoạt hóa hệ thống thần kinh giao cảm thượng thận (sympathoadrenal system) gây phóng thích epinephrine và các hormone chống điều hòa khác ngoài peptide vận mạch mạnh như endothelin. Hậu quả là một sự gia tăng lưu lượng máu não, cơ tim và các tạng đi kèm với giảm cung cấp máu đến da và lách.
Từ quan điểm về huyết động, hạ đường huyết có sự gia tăng trong công tim và nhu cầu oxy của cơ tim do tăng cung lượng tim, công tim, nhịp tim và co bóp cơ tim. Hơn nữa, có sự gia tăng huyết áp tâm thu ngoại vi, giảm sức cản động mạch ngoại biên kèm mở rộng của áp lực mạch và giảm huyết áp trung tâm. Sự gia tăng nồng độ catecholamine lưu hành gây ra giảm sức đề kháng động mạch ngoại biên thông qua đáp ứng giãn mạch qua thụ thể β-2.
Ở người bình thường, hạ đường huyết gây tăng tính đàn hồi của thành động mạch, gây ra sự trở lại của các sóng phản xạ trong thời kỳ tâm trương. Ở những bệnh nhân ĐTĐ, thành động mạch cứng hơn bình thường, gây ra sự trở về sớm hơn của sóng phản xạ trong thời gian cuối tâm thu; điều này can thiệp bất lợi tưới máu mạch vành, trong đó chủ yếu xảy ra trong tâm trương.
Ngoài ra, trong hạ đường huyết có sự kết hợp với hoạt hóa của hệ thống đông máu với tăng yếu tố VII, yếu tố von Willebrand, và hoạt hóa tiểu cầu. Ngoài ra, có sự gia tăng nồng độ CRP và các cytokine viêm, như interleukin-6, interleukin-8 và yếu tố hoại tử khối u yếu tố alpha (TNFα), có khả năng dẫn đến tổn thương nội mạc mạch máu
Cùng với thay đổi huyết động học và huyết học nói trên cung cấp chất nền cho thiếu máu cục bộ cơ tim và rối loạn nhịp tim trên hệ thống bệnh tim mạch ĐTĐ đã có từ trước.
Hình 3. Cơ chế tổn thương tim mach liên quan hạ đường huyết.
Nhóm ức chế β sử dụng thận trọng ở những bệnh nhân ĐTĐ, vì có thể mất đi các dấu hiệu cảnh báo của hạ đường huyết. Thông qua ức chế các thụ thể β-1, thuốc ức chế β có thể ức chế nhịp tim nhanh, là một trong những dấu hiệu cảnh báo sớm của hạ đường huyết . Do đó, ức chế β có thể dẫn đến hạ đường huyết không nhận biết, liên quan đến tiên lượng. Ngoài ra, ức chế β, nhờ ức chế thụ thể β 2 tại cơ và gan, ức chế thoái biến glycogen (glycogenolysis), nhằm dự phòng sự điều chỉnh đường huyết của hạ đường máu.
Thay đổi điện tim trong hạ đường huyết
Hạ đường huyết gây kích hoạt hệ thống thần kinh giao cảm (adrenosympathetic) chống điều hòa và do đó tạo ra sự bất ổn định điện tim và thay đổi điện sinh lý. Sự dẫn truyền nhĩ thất , khử cực tâm thất, và tái phân cực tất cả đều bị ảnh hưởng bởi hạ đường huyết. Trong trạng thái kẹp cường insulin/hạ đường huyết (Hyperinsulinemic hypoglycemic clamp state) sau khi đạt nồng độ glucose huyết tương cơ bản, truyền insulin liên tục được bắt đầu. Mức đường huyết được đo tại các khoảng thời gian đều đặn và glucose được truyền với tốc độ thay đổi để đạt được nồng độ glucose mục tiêu của ~ 50 mg / dL. Theo dõi ECG đồng thời ghi nhận sự thay đổi trong dẫn truyền nhĩ thất, khử cực tâm thất, và tái cực thất để đáp ứng hạ đường huyết.
Laitenen và các đồng nghiệp nghiên cứu trên đối tượng sử dụng trạng thái kẹp giảm đường cường insulin và cũng ghi nhận về tăng nồng độ catecholamine cùng với nhiều thay đổi đáng chú ý trên ECG với thời gian PR rút ngắn, đoạn ST chênh, sóng T dẹt , giảm diện tích sóng T và QTc kéo dài .Sự phóng thích Norepinephrine cũng được kết hợp với những thay đổi trong quá trình khử cực tâm thất và biên độ sóng R (rối loạn đẳng đường cường insulin gây ra sự khuếch đại biên độ sóng R) và sự phóng thích epinephrine kết hợp với những thay đổi trong quá trình tái cực thất và gây sóng T-dẹt. Nhiều nghiên cứu ghi nhận sóng T dẹt và tăng tỷ số R:T như là một trong những đặc trưng nhất và có lẽ là chỉ điểm hạ đường huyết trên ECG.
Các hiệu ứng tiền rối loạn nhịp (proarrhythmic effect) của hạ đường huyết ở bệnh nhân ĐTĐ được hiểu rõ hơn với mô hình hạ đường/cường insulin. Hạ đường huyết gây ra thiếu máu cơ tim im lặng cũng đã được đề xuất bởi nhiều tác giả. Desouza và cộng sự báo cáo một tỷ lệ cao hơn về mặt thống kê của ECG và thiếu máu cục bộ có triệu chứng trong giai đoạn hạ đường huyết so với đường huyết tăng khi so sánh với tăng đường máu cũng như đường máu bình thường trong nhóm nghiên cứu của tác giả này. Một số nghiên cứu đã báo cáo QTc kéo dài do hạ đường huyết gây ra và tiền rối loạn nhịp tim trong cả ĐTĐT1 và ĐTĐT2.. Nghiên cứu của Pappachan và các đồng nghiệp và nghiên cứu Whitsel và cộng sự ghi nhận nhóm bệnh nhân ĐTĐ trong nhóm tứ phân vị cao nhất của chỉ số QTc có nguy cơ cao gấp 3 lần với ngừng tim tiên phát so với các bệnh nhân ĐTĐ trong nhóm tứ phân vị đầu tiên. Điều này cho thấy có một mối liên hệ giữa đột tử và khoảng QTc kéo dài ở bệnh nhân ĐTĐ.
Hình 4. Biến đổi QTc trong hạ đường huyết
Một nghiên cứu dọc trên đối tượng ĐTĐT1 từ châu Âu và Diabetes Study (EURODIAB) báo cáo rằng hạ đường huyết nặng có liên quan độc lập với QTc kéo dài ở những bệnh nhân này. Bệnh thần kinh tim tự động là một yếu tố nguy cơ cho QTc kéo dài và được báo cáo tăng gấp hai lần ở bệnh nhân ĐTĐ bị bệnh so với không có nó. Như vậy, nguy cơ QTc kéo dài và rối loạn nhịp tim là hậu quả theo cấp số nhân tăng ở bệnh nhân ĐTĐ bị hạ đường huyết. Ảnh hưởng trên ECG của hạ đường huyết ở bệnh nhân ĐTĐ cần chú ý để giúp nhận biết sớm và điều chỉnh trong dân số bệnh nhân này, mà là cơ sở đã có nguy cơ mắc thiếu máu cục bộ thông qua gia tăng xơ vữa động mạch vành và mất ổn định điện tim qua QTc kéo dài.
III. CÁC THỬ NGHIỆM LÂM SÀNG HIỆN NAY LIÊN QUAN ĐẾN HẠ ĐƯỜNG HUYẾT
Các thử nghiệm lâm sàng lớn gần đây thông báo rằng hạ đường huyết làm gia tăng tiên lượng xấu ở bệnh nhân ĐTĐ. Ngoài ra phụ nữ, người già và những bệnh nhân ĐTĐ có bệnh đi kèm gia tăng nguy cơ cao hơn về biến cố hạ đường huyết. Trong kết luận, cả hai triệu chứng hạ đường huyết nặng và nhẹ đã kết hợp với tai biến tim mạch và tiện lượng nghiêm trọng đến sức khỏe trên đối tượng ĐTĐ.
Zoungas và cộng sự báo cáo rằng những bệnh nhân ĐTĐT2 trong thử nghiệm ADVANCE, ghi nhận hạ đường huyết có liên quan với sự gia tăng các biến cố . Qua theo dõi 5 năm, 231 bệnh nhân (2,1%) có ≥1 biến cố hạ đường huyết nặng; trong đó nhóm kiểm soát tích cực glucose tỷ lệ này là 2,7% (150/5571), và ở nhóm chứng là 1,5% (81/5569). Trong thời gian sau đó, đã có một sự gia tăng gấp 2,8 lần trong các biến cố mạch máu lớn và gấp 2,6 tăng tử vong do nguyên nhân tim mạch. Các yếu tố nguy cơ độc lập cho hạ đường huyết trầm trọng là người lớn tuổi, thời gian ĐTĐ kéo dài, nồng độ creatinine tăng, BMI thấp hơn, giảm chức năng nhận thức, sử dụng thuốc hạ đường huyết đường uống, tiền sử hút thuốc hoặc bệnh vi mạch máu và nhất là kiểm soát glucose tích cực (P <0,05). Tuy nhiên, các tác giả không thể phối hợp được sự lặp đi lặp lại của hạ đường huyết nặng với tiên lượng tử vong hoặc mạch máu.
Trong cả hai nghiên cứu ADVANCE và nghiên cứu ACCORD, tỷ lệ tử vong hàng năm ở những bệnh nhân đã được báo cáo hạ đường huyết nặng có thể cao hơn ở nhóm được điều trị theo phác đồ chuẩn so với nhóm được điều trị tăng cường. Ngoài ra, trong thử nghiệm ACCORD, mặc dù tỷ lệ cao hơn các triệu chứng hạ đường huyết nặng ở nhóm điều trị tăng cường , hạ đường huyết không được coi là một lý do có thể xảy ra đối với tỷ lệ tử vong quá mức kết hợp với kiểm soát bệnh. Trong các đối tượng có từ 1 biến cố hạ đường huyết trở lên, nguy cơ tử vong thấp hơn ở nhóm điều trị tăng cường so với nhóm điều trị chuẩn.
Hiện vẫn chưa rõ lý do tại sao tỉ lệ tai biến mạch máu lớn đã không được giảm xuống trong các cuộc thử nghiệm với kiểm soát đường huyết tích cực trong khi giảm đáng kể đã được ghi nhận trong tỷ lệ biến cố vi mạch máu. Một số khả năng tồn tại cho sự bất thường này, bao gồm cả thực tế là bệnh nhân lớn tuổi với một thời gian dài hơn DM, những bệnh nhân cần nhiều thuốc hạ đường huyết để duy trì kiểm soát đường huyết, và các bệnh nhân có tiền sử bệnh tim mạch từ trước có thể đại diện cho một tập hợp con có nguy cơ cao. Bệnh nhân trong nghiên ADVANCE những người trẻ tuổi có xu hướng ít biến cố khi được điều trị tăng cường . Ngoài ra, các thử nghiệm ACCORD tìm thấy tỷ lệ tử vong tăng ở những bệnh nhân được phân ngẫu nhiên khi điều trị tăng cường do không kiểm soát đường huyết. Nhiều nghiên cứu cần thiết để loại ra những vấn đề khó khăn của hạ đường huyết và biến cố tim mạch ở những bệnh nhân ĐTĐT2 điều trị bằng thuốc hạ đường huyết .
Hsu và cộng sự trình bày một nghiên cứu 77611 bệnh nhân mới được chẩn đoán ĐTĐT2 từ Viện Nghiên cứu sức khỏe Quốc gia Đài Loan từ năm 1998 đến năm 2009. Nghiên cứu này kiểm tra dân số bệnh nhân ngoại trú, nghiên cứu ưu tiên về hạ đường huyết, phần lớn từ các phân tích dịch tễ học của các thử nghiệm lâm sàng, liên quan đến nhồi máu cơ tim cấp tính và bao gồm các thử nghiêm “ Kiểm soát đường huyết tích cực bằng Insulin ở bệnh nhân ĐTĐ và nhồi máu cơ tim cấp tính (DIGAMI-2) và Đánh giá thử nghiệm chiến lược về hội chứng thiếu máu cục bộ (OASIS-6). Hsu và các cộng sự đã đánh giá hồi cứu tiên lượng bệnh nhân ĐTĐT2 với các biến cố hạ đường huyết so với các bệnh nhân ĐTĐ2 không hạ đường huyết. Họ nghiên cứu sự tương quan của hạ đường huyết với tỉ lệ tử vong và biến cố tim mạch toàn thể. Những tiên lượng kết thúc khác bao gồm đột quỵ, bệnh mạch vành, bệnh tim mạch và các nguyên nhân nằm viện. Có 1.844 biến cố hạ đường huyết được báo cáo, trong đó 500 bệnh nhân được nhập viện; 1.344 bệnh nhân ngoại trú là một trong số 77 611 bệnh nhân tham gia trên 10 năm. Họ tìm thấy một sự gia tăng gấp 2 lần tiên lượng xấu về tim mạch và nhập viện từ bất kỳ nguyên nhân trong ĐTĐT2 với hạ đường huyết lâm sàng, ngay cả sau khi đã hiệu chỉnh. Theo nghiên cứu ACCORD, phân tích dịch tễ hồi cứu tìm thấy tỷ lệ nguy hiểm 2,87 cho tất cả nguyên nhân tử vong ở bệnh nhân. Hạ đường huyết nặng so với không nặng ở nhóm điều trị chuẩn. Hạ đường máu có thể là một dấu chỉ điểm cho mức độ nghiêm trọng của bệnh mạch máu trong những bệnh nhân thường được điều trị mẫu mực. Những bệnh nhân này sư dụng insulin hoặc sulfonylurea với nghi ngờ khó kiểm soát HbA1c. Có thể trong thực tế, có một tia sáng cơ hội để sử dụng kiểm soát chặt chẽ glucose máu cực ở những bệnh nhân mới được chẩn đoán với ĐTĐ. Trong nghiên cứu biến chứng và kiểm soát đái tháo đường (DCCT), ở những bệnh nhân ĐTĐT1 với thời gian trung bình là 5,7 năm và tuổi trung bình là 27 năm, một liệu pháp hạ đường tích cực làm tăng nguy cơ hạ đường huyết nặng không gây ra kết quả bất lợi tim mạch.
Sơ đồ 2. Hạ đường huyết nặng và nhẹ đều ảnh hưởng đến tiên lượng .
So sánh có suy tim tâm thu có tuổi thọ hơn 5 năm.
Sơ đồ 3. Liên quan đáng kể giữa các biến cố hạ glucose máu ở ĐTĐ týp 2. Hạ đường huyết nặng tiện lượng xấu hơn, ngay cả hạ đường huyết nhẹ cũng giảm tuổi thọ 10 năm..
Sơ đồ 4 . Bệnh nhân hạ glucose máu nặng tăng nguy cơ tim mạch.
Có sự tăng đáng kể rối loạn lipid máu ở nhóm ĐTĐ týp 2 không hạ glucose máu .
Tóm lại, trong nghiên cứu ACCORD, điều trị hạ đường huyết tích cực khi so sánh với điều trị chuẩn làm tăng nguy cơ tử vong tim mạch. Ngược lại, trong các thử nghiệm ADVANCE và nghiên cứu hồi cứu ĐTĐ của Vương quốc Anh (UKPDS), không thấy ảnh hưởng về tỷ lệ tử vong tim mạch giữa nhóm hạ đường huyết tích cực và điều trị chuẩn. Để đơn giản hóa các kết quả này, ở những bệnh nhân với ĐTĐT2, kiểm soát đường huyết chặt chẽ, làm tăng nguy cơ hạ đường huyết nặng, làm giảm nguy cơ nhồi máu cơ tim, không ảnh hưởng đến đột quỵ và có ảnh hưởng phối hợp và không chắc chắn về tỷ lệ tử vong tim mạch.
- AN TOÀN GIAO THÔNG VÀ HẠ ĐƯỜNG HUYẾT
Hạ đường huyết liên quan đến sự gia tăng nguy cơ tai nạn xe cơ giới trên đối tượng ĐTĐ. Thật vậy lái xe là một thao tác phức tạp liên quan đến sự phối hợp các kỹ năng quan sát, nhận thức và vận hành có thể bị rối loạn do ảnh hưởng cấp cũng như mạn tính của bệnh ĐTĐ. Biến chứng ĐTĐ như bệnh võng mạc có thể dẫn đến giảm thị trường quan sát và thị lực. Bệnh lý thần kinh ngoại biên có thể giảm sự nhận cảm ở chi dưới, cản trở việc sử dụng thích hợp của bàn đạp. Biến chứng cấp tính như hạ đường huyết và tăng đường huyết có thể tác động đến sự nhận thức và suy đoán của người lái xe mắc bệnh ĐTĐ. Nhiều nghiên cứu khoa học đánh giá mối liên quan giữa các biến chứng ĐTĐ, bao gồm cả tăng đường huyết và hạ đường huyết và lái xe an toàn. Một phân tích gần đây đã kết luận rằng những người mắc bệnh ĐTĐ có nguy cơ gia tăng tai nạn xe cơ giới từ 12% đến 19%. Các nghiên cứu tập trung vào bệnh nhân ĐTĐT1 ghi nhận rằng họ đã có gấp hai lần số va chạm và tăng vi phạm di chuyển xe khi so sánh với vợ hoặc chồng của họ không bị ĐTĐ. Một nghiên cứu hồi cứu tiếp theo, bao gồm 452 bệnh nhân ĐTĐT1 báo cáo 52% hạ đường huyết liên quan rủi ro lái xe, với 5% của các đối tượng báo cáo đã có trên 6 lần rủi ro.Các thử nghiệm kiểm soát đã được thực hiện trong một nỗ lực để xác định các yếu tố liên quan đến tai nạn lái xe trong quá trình điều khiển với bệnh nhân ĐTĐT1. Một nghiên cứu cho thấy người lái xe có tiền sử gây những tai nạn lái xe đòi hỏi truyền dextrose nhiều hơn để duy trì đường huyết bình thường và trong khi gây hạ đường huyết đang tiến triễn đã chứng minh phóng thích ít epinephrine và khiếm khuyết lái xe nhiều hơn khi so sánh với các tài xế không có tiền sử lái xe rủi ro. Một nghiên cứu tiếp theo khẳng định những kết quả trên và cũng đã chứng minh rằng lái xe với tiền sử rủi ro gây tai nạn có triệu chứng cơ năng hạ đường huyết ít hơn, chậm tốc độ xử lý thông tin và bộ nhớ tồi hơn. Những nghiên cứu này cùng nhau xác định ở tài xế có nguy cơ cao có độ nhạy insulin cao hơn và cơn hạ đường huyết xảy ra thường xuyên hơn với sự giảm cơ chế điều hòa ngược, ngay cả trong trường hợp hạ đường huyết mức độ trung bình.
Theo quan điểm minh chứng về đạo đức và pháp lý liên quan tài xế mắc ĐTĐ , Hiệp hội ĐTĐ Mỹ đã đưa ra khuyến cáo “Những bệnh nhân ĐTĐ nên được thăm dò cá nhân hóa, về tiền sử bệnh của mỗi cá nhân cũng như những rủi ro tiềm tàng liên quan đến quá trình lái xe ” Tài xế các yếu tố nguy cơ tiềm tàng hạ đường huyết nên được tư vấn như sau:
(1) Thử đường máu trước khi lái xe
(2) Không bao giờ bắt đầu khởi động nồng độ glucose máu bình thường thấp (ví dụ, 70-90 mg / dL) mà không có các thức uống hoặc thức ăn chứa đường nhằm dự phòng;
(3) Luôn mang theo máy đo đường huyết và các loại thực phẩm thích hợp trong xe;
(4) Dừng xe ngay lập tức khi có triệu chứng của hạ đường huyết dựa theo kinh nghiệm
(5) Không được tiếp tục lái xe cho đến khi tài xế hồi phục đường máu và sự nhận thức. Trong kết luận, các biến chứng của ĐTĐ có thể cản trở khả năng hoạt động cần thiết cho lái xe, do đó đặt ra một nguy cơ cao hơn tai nạn xe cơ giới. Các bác sĩ có trách nhiệm về pháp lý và đạo đức để giáo dục người mắc ĐTĐ trong việc thực hành các biện pháp an toàn và phòng ngừa.
TÀI LIỆU THAM KHẢO
- Seaquist ER, Anderson J, Childs B, et al. Hypoglycemia and diabetes: a report of a workgroup of the american diabetes association and the endocrine society. Diabetes Care. 2013;36:1384–1395.
- Yakubovich N, Gerstein HC. Serious cardiovascular outcomes in diabetes: the role of hypoglycemia. Circulation. 2011;123:342–348.
- Duckworth W, Abraira C, Moritz T, et al; VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes.Engl J Med. 2009;360:129–139.
- Gerstein HC, Miller ME, Byington RP, et al; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008;358:2545–2559.
- Riddle MC, Ambrosius WT, Brillon DJ, et al; Action to Control Cardiovascular Risk in Diabetes Investigators. Epidemiologic relationships between A1C and all-cause mortality during a median 3.4-year follow-up of glycemic treatment in the ACCORD trial.Diabetes Care. 2010;33:983–990.
- American Geriatrics Society 2012. Beers Criteria Update Expert Panel. American Geriatrics Society updated Beers Criteria for Clin. Cardiol. 37, 8, 499–504 (2014) 503
012;60:616–631.
- Frier BM, Schernthaner G. Hypoglycemia and cardiovascular risks. Diabetes Care. 2011;34(suppl 2): S132–S137.
- Gruden G, Giunti S, Barutta F, et al. QTc interval prolongation is independently associated with severe hypoglycemic attacks in type 1 diabetes from the EURODIAB IDDM complications study.Diabetes Care. 2012;35:125–127.
- Zoungas S, Patel A, Chalmers J, et al. Severe hypoglycemia and risks of vascular events and death. N Engl J Med. 2010;363:1410–1418.
- Bonds DE, Miller ME, Bergenstal RM, et al. The association between symptomatic, severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemiological analysis of the ACCORD study. BMJ. 2010;340:b4909.
- Hsu PF, Sung SH, Cheng HM, et al. Association of clinical symptomatic hypoglycemia with cardiovascular events and total mortality in type 2 diabetes: a nationwide population-based study. Diabetes Care. 2013;36:894–900.
- Goyal A, Mehta SR, D´ıaz R, et al. Differential clinical outcomes associated with hypoglycemia and hyperglycemia in acute myocardial infarction. Circulation. 2009;120:2429–2437.
- Cox DJ, Singh H. Diabetes and driving safety: science, ethics, legality and practice. Am J Med Sci. 2013;345:263–265.
- ECRI. Diabetes and Commercial Motor Vehicle Driver Safety, June 2011 Update. Plymouth Meeting, PA: ECRI; June 2011.
- Yancy CW, Jessup M, Bozkurt B, et al; Writing Committee Members. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice
guidelines. Circulation. 2013;128:e240–e327.
 Hội Nội tiết và Đái Tháo đường Thừa Thiên Huế
Hội Nội tiết và Đái Tháo đường Thừa Thiên Huế